以嵌合抗原受体修饰的 T 细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy,CAR-T)开创了治疗血液系统恶性肿瘤的新时代。然而,经过高度筛选的患者的总体反应率(ORR)仍然不足[1]。此外,只有一小部分患者通过免疫治疗实现了长期缓解。CAR-T细胞通过特异性识别肿瘤细胞和释放细胞毒性来实现对肿瘤的杀伤,如能精准可视化和分析这些动态过程,将可有效识别疗效相关生物标志物,评估CAR-T细胞的杀伤功能,进而预测基于T细胞的细胞免疫疗法的疗效。然而,因为现有荧光显微成像工具在时空分辨率和光侵入性方面的限制,当前对CAR-T细胞的功能研究主要集中在对细胞群体的典型属性的分类上,难以在亚细胞水平开展CAR-T细胞杀伤肿瘤细胞的大规模、高通量、长时程表型观测和精准分析。
针对上述挑战,华中科技大学光学与电子信息学院费鹏教授与该校同济医学院附属同济医院血液内科张义成教授、陈丽婷副研究员等带领的交叉学科团队,在Nature Communications上发表了题为“3D live imaging and phenotyping of CAR-T cell mediated-cytotoxicity using high-throughput Bessel oblique plane microscopy”的研究论文,论文提出了一种高通量贝塞尔单物镜光片显微镜(HBOPM)平台,该平台能够智能3D实时成像和评估CAR-T细胞对肿瘤细胞的杀伤行为,以各向同性的亚细胞分辨率,对芯片上数百对相互作用的T细胞/肿瘤细胞进行数小时的长时程观察,并对获取的TB级多通道、3D动态图像数据集进行定量分析。研究者使用这种先进的显微镜平台,捕获并全面分析了CAR-T细胞在杀伤过程中的多个关键亚细胞事件,包括免疫突触的瞬时形成,回流和微管形态的持续变化。

研究者研发了整套高通量自动化的HBOPM活细胞光片成像技术流程(如下图1所展示)。首先通过制备由大量折射率匹配微腔构成的微流芯片,将CAR-T细胞装载于微腔芯片内进行高通量扫描。随后由智能成像软件自动识别图像中微腔内的细胞数量和状态,然后切换高倍光片模式对选中的CAR-T细胞与靶细胞进行快速,高分辨的三维时序成像。本研究开发的单物镜光片显微镜具有秒级的体成像速率,且分辨率可达各向同性320 nm。同时,通过在照明光路中引入双环衍射调制[2],扩展了光片照明的范围且降低了传统贝塞尔光片的旁瓣干扰,显著提升显微镜的成像深度,实现对悬浮细胞的长时程成像。
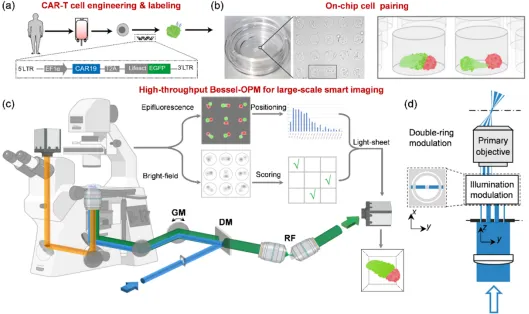
图1 高通量贝塞尔斜平面显微镜(HBOPM)工作流程
接下来,研究者针对大规模的细胞图像开发了高效数据分析软件,能够批量处理TB量级的三维多通道时序图像,并将免疫细胞的形态特征量化为KB大小的数据报表。量化算法将深度学习与机器视觉算法相结合,深度学习负责基础图像分割任务,对高动态范围的荧光信号中具良好的适应性,细胞形态相关的高级语义信息则通过机器视觉算法提取,避免了深度学习算法的不可解释问题。算法分析了CAR-T细胞的免疫突触面积、免疫突触的肌动蛋白耗竭系数、肌动蛋白流动速度、中心体极化角等信息,从多维度剖析了CAR-T细胞杀伤状态和行为。
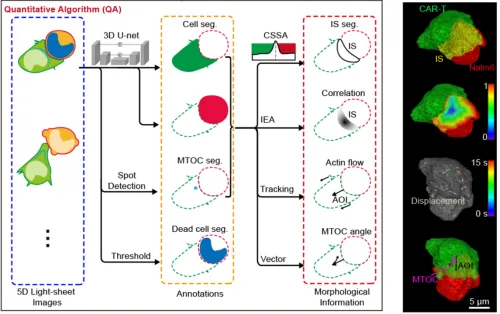
图2 细胞行为特征量化分析算法
基于上述平台,研究者对总计419组细胞进行了三维多通道时序图像的采集和数据分析,并使用达沙替尼[3]抑制CAR-T细胞功能,进行了对照实验。在对照组(图3黑色数据点)与药物抑制组(图3蓝色数据点)中,可以观察到CAR-T细胞的免疫突触面积、免疫突触的肌动蛋白耗竭系数、肌动蛋白流动速度均在药物处理后显著下降,实验结论具有可重复性与统计显著性,这表明上述指标具有评估CAR-T细胞杀伤功能的作用。此外,中心体极化角虽然在实验组与对照组之间不存在显著性差异,但其分布表明中心体无论是否受到达沙替尼的抑制,中心体都有指向靶细胞的趋势,这可能意味着中心体极化现象在细胞免疫过程中具有更高的优先级。
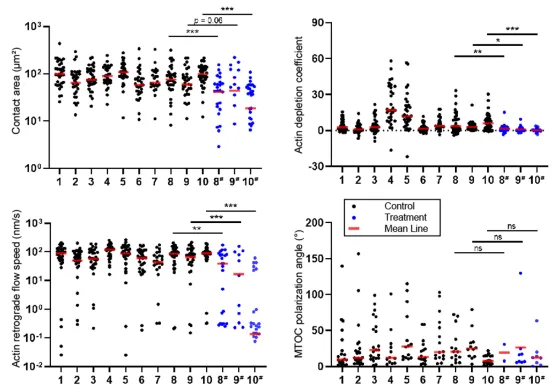
图3 量化数据统计分析
简言之,该研究提出了一种高通量的贝塞尔单物镜光片显微成像技术以及多维细胞数据分析方法,能够三维实时观测CAR-T细胞对肿瘤细胞的杀伤行为,并进行自动化的数据量化分析。研究将有助于建立量化T细胞功能的标准,为所有以T细胞为基础的免疫治疗带来新的洞见。
华中科技大学光电学院博士生王兆飞、王婕,博士后赵宇轩,同济医院毕业生金瑾为论文共同第一作者。华中科技大学光电学院费鹏教授,同济医院血液内科陈丽婷副研究员为论文共同通讯作者。
参考文献
1、C. H. June, M. Sadelain. Chimeric Antigen Receptor Therapy. New England Journal of Medicine, 2018, 379(1): 64–73.
https://www.doi.org/10.1056/NEJMra1706169
2、 Y. Zhao, M. Zhang, W. Zhang, Y. Zhou, L. Chen, Q. Liu, et al. Isotropic super-resolution light-sheet microscopy of dynamic intracellular structures at subsecond timescales. Nature Methods, 2022, 19(3): 359–369.
https://www.doi.org/10.1038/s41592-022-01395-5
3、K. Mestermann, T. Giavridis, J. Weber, J. Rydzek, S. Frenz, T. Nerreter, et al. The tyrosine kinase inhibitor dasatinib acts as a pharmacologic on/off switch for CAR T cells. Science Translational Medicine, 2019, 11(499): 5907.
https://www.doi.org/10.1126/scitranslmed.aau5907
专家点评:上海交通大学医学院附属瑞金医院,陈赛娟院士
免疫治疗自2013年被《Science》杂志评为年度最重要的科学突破以来,一直备受关注。在癌症的免疫疗法中,治疗的标靶不是直接针对肿瘤而是针对身体的免疫系统,促使T细胞和其它免疫细胞来对抗肿瘤。这种治疗策略已经颠覆性地改变了肿瘤治疗的理念和治疗模式,并会在未来5-10年内有望成为肿瘤治疗的基石治疗方法,惠及巨大的肿瘤人群。目前限制“癌症免疫治疗”领域进一步发展的、亟待解决的最关键的问题之一,就是部分患者对治疗没有响应无法缓解,但是没有有效方法提前甄别这类患者。免疫治疗领域亟需预测治疗疗效的新方法和方案。T细胞功能健全,是CAR-T细胞疗法等以T细胞为基础的免疫治疗取得成功的必要条件。监测患者T细胞以及T细胞产品的功能,将有助于预测CAR-T治疗疗效。
华中科技大学光学与电子信息学院费鹏教授与该校同济医学院附属同济医院血液内科张义成教授、陈丽婷副研究员等带领的交叉学科团队,利用先进的高通量贝塞尔斜平面光片显微镜和微流控芯片,大规模、高分辨率地解析了CAR-T细胞杀伤靶细胞的4D长时程动态数据,并通过自研的算法识别了与CAR-T功能高度相关的表型指标包括:免疫突触的实时面积、肌动蛋白的回流速度、微管组织中心偏振角等。
这项工作代表了免疫细胞杀伤肿瘤成像领域的重大突破,并有望应用于预测CAR-T细胞治疗患者疗效,以及筛选合适的患者,满足临床需求,弥补这一领域空白。
华中科技大学光电学院和同济医院血液内科组成的医工交叉团队致力于利用先进成像技术推进血液肿瘤的研究。费鹏教授课题组在光片显微成像技术及多维生物医学图像处理分析方面长期耕耘,成果近年连续在Nature Methods,Nature Communications,PNAS 等期刊发表。发展的新技术已在细胞生物学,肿瘤医学,组织病理学等多类研究中获得应用。张义成教授带领的同济医院血液内科,是全国最早开展CAR-T细胞治疗的中心之一,同时是湖北省血液免疫细胞治疗临床医学研究中心的依托单位,其CAR-T细胞治疗相关的成果曾连续三年荣获“中国血液学十大研究进展”,研究成果在blood,Transplant Cell Ther,Exp Hematol Oncol等期刊发表。陈丽婷副研究员深耕CAR-T细胞治疗疗效相关的生物标记物多年,以第一/通讯作者在Nature Communications, Molecular Therapy, Signal Transduct Target Ther, J. ImmunoTher等期刊发表论文。
我衷心祝贺费鹏/张义成/陈丽婷团队,并期待他们的下一个突破性成果。
下一页





