光片“慧眼”探秘:解锁 CAR-T 细胞杀伤的高通量 3D 动态全过程
所属分类:
发布时间:2025-08-04 15:55
CAR-T 细胞疗法开创了血液肿瘤治疗新时代,但存在响应率低、持续时间短、疗效预测难等痛点。细胞毒性过程的可视化,有预测疗效的潜力。然而,CAR-T 细胞群体存在显著异质性,单细胞分析难以反映整体功能,亟需高通量成像技术大规模高清观测。当前主流荧光显微镜难以同时满足高分辨率、长时程追踪和高通量需求。新兴的光片荧光显微技术(LSFM)虽可实现快速、低毒的三维成像,但其样品装载和数据分析效率不足,限制了大规模细胞事件的研究。
华中科技大学光学与电子信息学院费鹏教授与该校同济医学院附属同济医院血液内科张义成教授、陈丽婷副研究员等带领的交叉学科团队在《Nature Communications》发表的研究,通过一种高通量贝塞尔斜平面显微镜(HBOPM),首次大规模实时捕捉到 CAR-T 细胞杀伤癌细胞的亚细胞级动态过程,为解开这一谜题提供了 “上帝视角”。

▍传统显微镜的 “三大困境”,制约 CAR-T 研究
要理解 HBOPM 的突破,先得看看传统成像技术在 CAR-T 研究中遇到的瓶颈:
为了突破这些限制,研究团队开发了高通量贝塞尔斜平面显微镜(HBOPM),它以光片荧光显微镜(LSFM)为基础,结合双环调制贝塞尔光片和倒置单物镜成像模态等创新技术,将照明与检测光路整合至同一高 NA 物镜(N.A. 1.3 硅油镜),单物镜光路设计突破了光片显微镜的分辨率极限,达到亚细胞级分辨率。且为倒置开顶式设计,可以兼容多种常规载具,如文中使用的微腔细胞芯片,可实现高通量观测,成为观察 CAR-T 细胞的 “理想工具”。
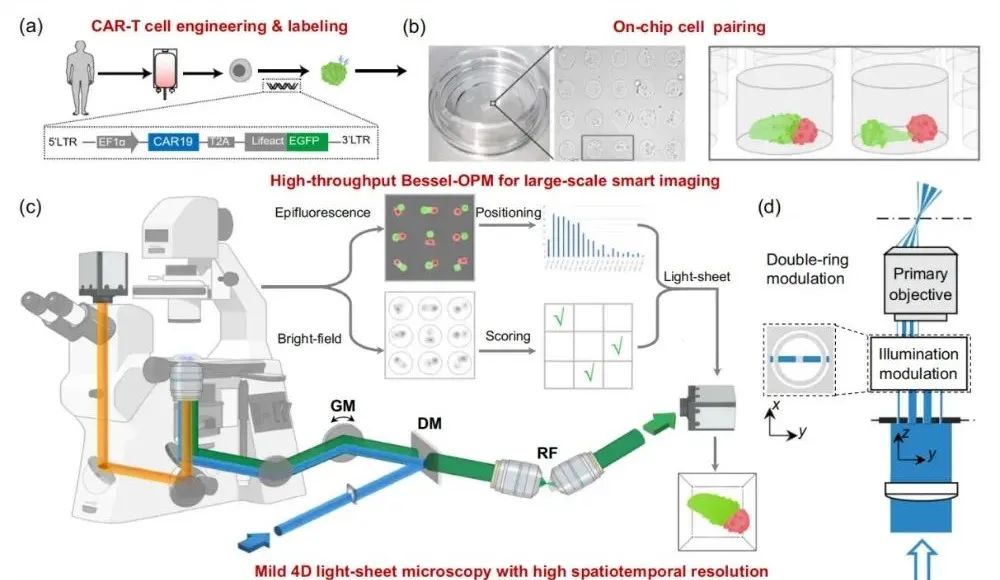
【图 1,高通量贝塞尔斜平面显微镜(HBOPM)的装置示意图】
传统显微镜的分辨率常存在 “轴侧向差异”(即上下方向分辨率低于左右方向),导致 3D 图像失真。而 HBOPM 通过采用双环贝塞尔光片照明和 60 × 1.3NA 的硅油物镜,结合深度学习超分辨率重建算法,实现了 320 nm 的各向同性分辨率,秒级体成像速率,看清“战斗细节”。
∆ 视频:CAR-T 细胞(绿色)对肿瘤细胞(红色)的杀伤行为
60×1.3NA 硅油物镜 拍摄
CAR-T 细胞杀伤靶细胞是一场 “持久战”,从接触、激活到完成杀伤可能需要 5 小时以上。传统显微镜的强光会加速细胞死亡,根本撑不到这场 “战役”结束。
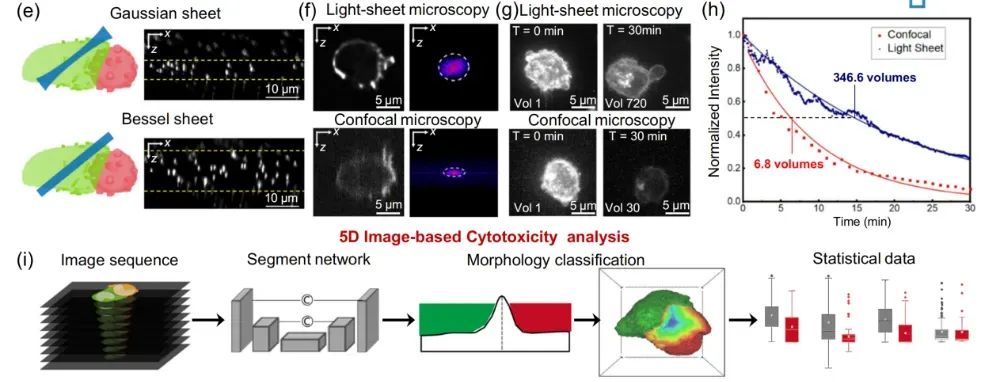
【图 2. HBOPM 与传统共聚焦显微镜的分辨率及光毒性对比】
CAR-T 细胞的疗效差异很大,要找到规律,必须观察足够多的细胞对。研究者开发了一种由大量折射率匹配的微腔组成的细胞芯片,其折射率与水相同;含 2000 个微室的芯片(每个微室容纳一对 CAR-T 细胞和靶细胞),配合智能成像算法,能自动识别并锁定 400 多个有效细胞对,同时进行高通量扫描。CIS 与 LIS的结合有效平衡了短时动态和长时效应的观测需求,提升了成像通量并确保细胞活性,为细胞毒性活动的全面可视化提供了技术支持。
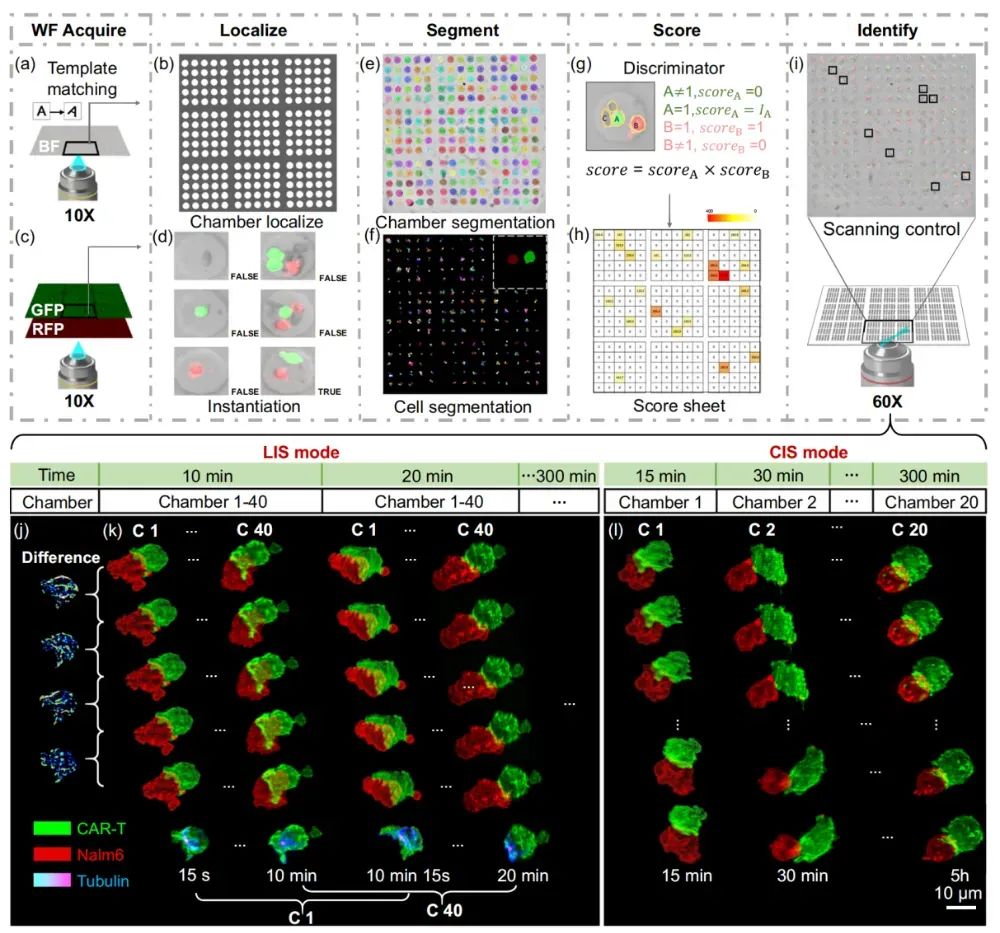
【图 3,智能成像流程与成像策略示意图】
-
免疫突触(IS)面积 -
肌动蛋白逆流速度 -
免疫突触肌动蛋白耗减系数 -
MTOC 极化角度 -
肿瘤细胞死亡率
其中,肿瘤细胞死亡率可通过 SYTOX BLUE 染色直接测定,其余指标则需要通过算法从图像中提取。例如,通过接触面分割算法(CSSA),精确分割 3D 免疫突触接触面并计算其面积;利用迭代腐蚀算法(IEA),计算免疫突触像素至中心的距离,并结合 F-actin 荧光强度评估肌动蛋白耗减系数。
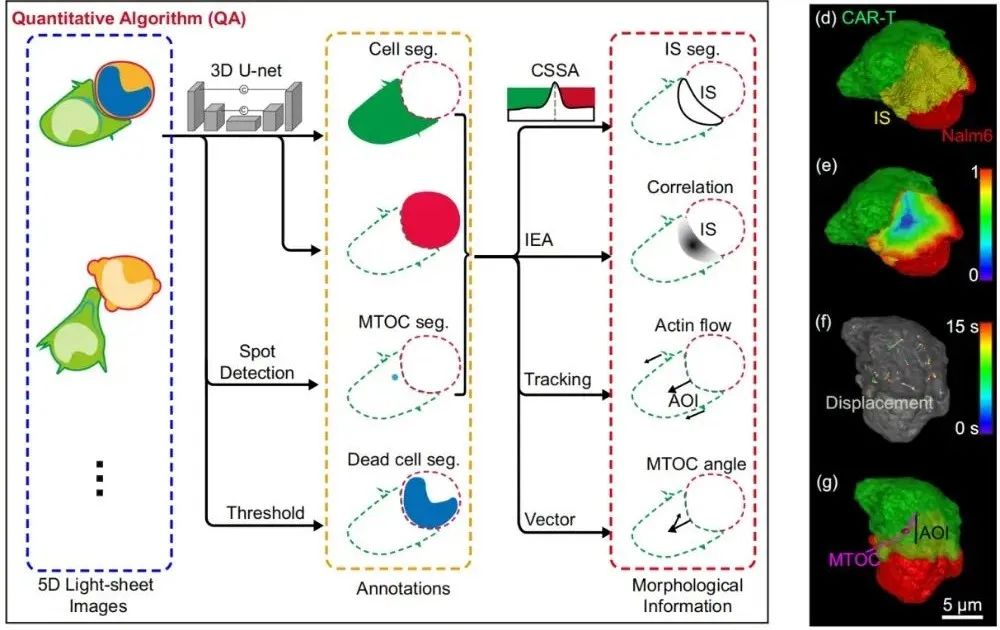
【图4. 细胞毒性分析算法(CAAs)的工作流程示意图】
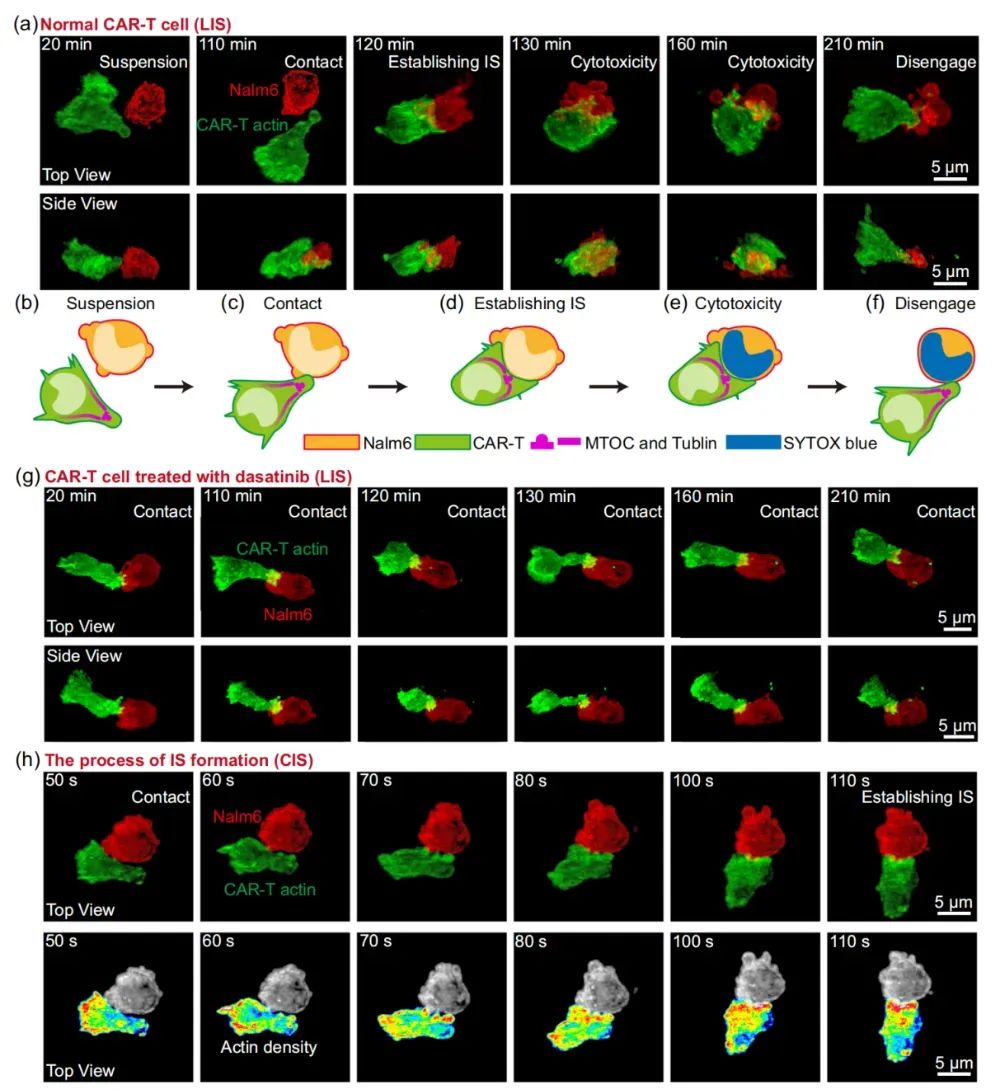
【图 5,CAR-T 细胞杀伤靶细胞的动态过程】
高通量长时程高分辨的光片显微成像技术让 CAR-T 细胞的 “神秘杀伤机制” 变得清晰可见,其意义不止于基础研究,可为所有 T 细胞免疫疗法建立“功能量化标准”,医生能预判其杀伤能力,制定更精准的治疗方案,所有基于杀伤细胞的免疫疗法都具备利用该平台深入研究细胞微观行为的潜力。预计该方法将有效推动癌症免疫治疗发展,并为未来临床试验提供有力支持,引领个性化癌症免疫治疗新时代。
🏆 技术升级:新一代光片——灵活变倍,探索更自由
慧观生物聚焦于光片显微成像技术前沿,依托国家杰青费鹏教授团队的创新技术成果,通过持续的研发迭代,针对 HBOPM 的倍率切换及易用性进行了优化,公司升级推出了全新一代单物镜光片显微镜-SmartView。该产品采用单物镜模态,通过巧妙的光学设计,新增超景深共焦探测和斜面直读技术,不再需要倾斜矫正的 O2、O3 物镜,突破了传统光片显微镜的倍率限制,可实现 4 ×-100 × 不同物镜的灵活切换,兼具共聚焦的操作习惯和光片的成像优势,并为科研探索提供了更多的灵活性与便利性。目前已获得清华大学、同济医院、中国科学院神经科学研究所等众多顶尖科研单位的青睐。






