显微镜「卷王」诞生!单物镜光片技术让跨尺度观测〝纵享丝滑〞
所属分类:
发布时间:2025-06-25 14:48
细胞内的线粒体、内质网、高尔基体等结构不仅分布复杂,还时刻处于高速动态变化中。细胞器的成像面临三大挑战,单物镜光片显微镜通过光学切片技术应对:
|
挑战 |
成像缺陷 |
解决方案 薄层光片+单物镜 |
|
时空分辨率要求高 |
运动模糊,难以解析精细结构和毫秒级动态 |
面阵曝光提升速度;超薄光片+高 NA 油镜提升分辨率 |
|
光毒性 |
细胞损伤、皱缩,生理状态失真 |
薄层激发减少光暴露,支持长时间活体成像 |
|
三维成像能力差 |
离焦模糊,立体结构信息缺失 |
光片层切技术+3D 重建实现高精度各向同性分辨率 |
☆ 应用案例:利用该技术对细胞中线粒体外膜进行高分辨率的三维成像,为线粒体动力学的理解提供了直接视觉证据。
∆ 视频:线粒体外膜三维成像,使用 SmartView 100 × /N.A. 1.5 的油镜拍摄。
现代生命科学研究迫切需要能在数天时间内无损观测活细胞动态的技术,但传统荧光显微镜仍旧存在以下挑战,单物镜光片都一一应对:
|
挑战 |
致命缺陷 |
解决方案 优化光片显微镜 |
|
光毒性 |
细胞光损伤,无法维持数天观测 |
超薄光片激发;低功率激光兼容长时程成像 |
|
细胞处于悬浮状态 |
离焦模糊,导致三维结构失真 |
一次扫描,三维可得,动态补偿悬浮样本漂移,稳定成像 |
|
时空分辨率不足 |
高速动态变化记录缺失,无法精准动态追踪
|
超薄光片+面阵扫描+高 NA 物镜(高穿透深度+折射率匹配),各向同性分辨率结合 3D 重建 |
☆ 应用案例:单物镜光片显微镜能在细胞芯片中,实时监测免疫细胞的杀伤行为。
2024年华中科技大学光学与电子信息学院费鹏教授与该校同济医学院附属同济医院血液内科张义成教授、陈丽婷副研究员等带领的交叉学科团队,在 Nature Communications 上发表了题为《3D live imaging and phenotyping of CAR-T cell mediated-cytotoxicity using high-throughput Bessel oblique plane microscopy”》 的研究论文[1],论文提出了一种高通量贝塞尔单物镜光片显微镜(HBOPM)平台,该平台能够智能 3D 实时成像和评估 CAR-T 细胞对肿瘤细胞的杀伤行为,以各向同性的亚细胞分辨率,对芯片上数百对相互作用的T细胞/肿瘤细胞进行数小时的长时程观察,并对获取的 TB 级多通道、3D 动态图像数据集进行定量分析。
3. 解锁[类器官]的完整三维结构
类器官作为组织再生与疾病建模的新兴平台,具有结构复杂、尺寸较大、三维立体的特点,以下是主流成像技术在检测类器官时存在的挑战,以及单物镜光片显微镜的应对策略:
|
挑战 |
关键问题 |
解决方案 单物镜光片显微镜 |
|
分辨率与成像深度 |
厚样本(毫米级)导致3D 结构模糊或信息丢失 |
大视野深度成像:直接穿透毫米级类器官,亚细胞分辨率接近各向同性 |
|
光毒性 |
长时程观测导致类器官活性下降或死亡 |
低光毒设计:薄层激发+活细胞工作站,支持数天连续观测 |
|
高通量成像 |
共聚焦点扫描成像方式速度慢,无法满足类器官芯片高通量筛选需求 |
高通量:面阵扫描成像,兼容培养皿/器官芯片 |
|
灵敏度 |
检测灵敏度不足,内源性信号遗漏 |
高灵敏度:超高光子利用率 |
☆ 应用案例:肠道类器官的深层三维成像。
∆ 视频:肠道类器官 150μm/未透明化,SmartView 30× NA1.05 SIL 物镜拍摄,样本来源:清华大学陈晔光老师团队
在器官发育、病理机制等研究中,以下是使用主流技术进行全器官成像时存在的挑战,以及单物镜光片的应对策略:
|
挑战 |
关键问题 |
突破性解决方案 单物镜光片显微镜 |
|
难以兼顾大尺寸和分辨率 |
器官包含多种细胞类型,需亚细胞级分辨率 |
多尺度兼容设计:μm 级亚细胞至 cm 级器官成像 |
|
成像深度与清晰度矛盾 |
毫米级组织导致信号衰减,深层图像质量下降 |
深层高质量成像:光片技术减少散射,保持高穿透高图像质量 |
|
成像速度慢 |
全器官扫描耗时,时间成本过高 |
全器官快速扫描:高速三维成像(分钟级完成) |
☆ 应用案例:可在单细胞分辨率下快速完成完整鼠脑成像,无需物理切片,深度更深,速度更快。
大多数显微成像方案在 FOV 和轴向分辨率之间进行权衡,这使得在介观尺度上以 3D 细胞分辨率观察模式动物的高度动态过程具有挑战性,而单物镜光片显微镜通过创新设计,解决了这些矛盾:
|
挑战 |
局限问题 |
单物镜光片显微镜的突破 |
|
大视场体积成像 |
大视场下光片厚度不均一导致轴向分辨率不均一 |
光学设计: |
|
时间分辨率 |
模式动物自由移动及难以捕捉毫秒级钙信号 |
面阵探测: 实现体积成像速度最大化 |
|
空间分辨率 |
轴向分辨率不足,难以精准解析空间结构 |
超薄光片+高NA物镜:同步维持亚细胞级空间分辨率 |
|
光毒性 |
高功率激发损伤样本,难以长时程活体成像 |
薄层动态照明: |
☆ 应用案例1:斑马鱼整体运动神经元与肌肉成像[2]
华中科技大学费鹏教授团队为了在大视场(FOV)上快速获取大量细胞信息,开发了能够在细胞分辨率下对中尺度标本进行高通量体积成像的光片显微镜,研究者展示了双色转基因斑马鱼胚胎(受精后 3 天) 分别在运动神经元(Islet1-GFP)和体节快肌(mlcr-DsRed)处标记有绿色和红色荧光蛋白。此外,这项工作对受精后 48 至 72 小时(hpf) 的麻醉活鱼胚胎进行了时程研究,以研究后脑区域的神经元/肌肉发育。
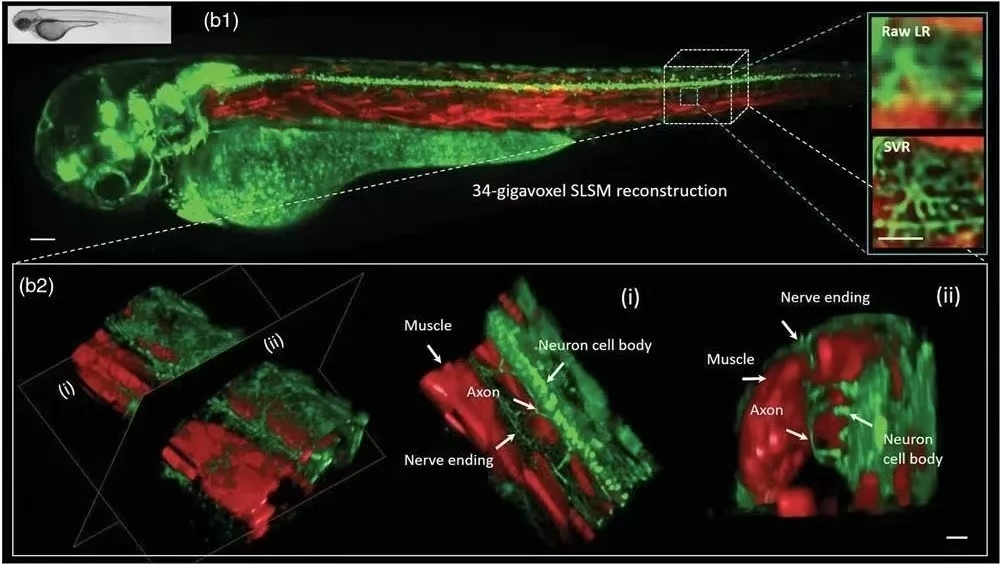
∆ 图:(b1)麻醉活斑马鱼胚胎 (3 dpf) 的双色 SVR 重建(b2) 鱼体节切片 SVR 重建中的放大体积渲染。比例尺:100 μm 对于整个胚胎图像(放大视图:20 μm)。
单物镜光片显微镜已成为完整模式生物长时程高分辨成像的利器,在对光敏感的动态过程和低光毒性干扰要求严格的领域获得广泛认可。
约翰霍普金斯大学的研究团队为了克服大视场下分辨率的限制,开发了带有衍射光片的介观斜平面显微镜(Meso-OPM)。实现 5.4 mm × 3.3 mm 超大视场,分辨率达 2.5 μm × 3 μm × 6 μm,单次扫描即可完成 3D 细胞成像。[3]
团队利用 Meso-OPM,以 2 Hz 的体积速率持续 85 秒捕获了整个斑马鱼神经系统的自发钙信号,同时以 5 Hz 记录了全身血流动力学,具有 3D 细胞分辨率。实验不仅清晰呈现了 60 个神经元在不同深度的动态荧光轨迹,还证明了该技术在介观尺度下对高度动态过程的捕捉能力。
单物镜光片显微镜已成为完整模式生物长时程高分辨成像的利器,在对光敏感的动态过程和低光毒性干扰要求严格的领域获得广泛认可。
☆ 应用案例2:斑马鱼整体神经活动动态记录。
约翰霍普金斯大学的研究团队为了克服大视场下分辨率的限制,开发了带有衍射光片的介观斜平面显微镜(Meso-OPM)。实现 5.4 mm × 3.3 mm 超大视场,分辨率达 2.5 μm × 3 μm × 6 μm,单次扫描即可完成 3D 细胞成像。[3]
团队利用 Meso-OPM,以 2 Hz 的体积速率持续 85 秒捕获了整个斑马鱼神经系统的自发钙信号,同时以 5 Hz 记录了全身血流动力学,具有 3D 细胞分辨率。实验不仅清晰呈现了 60 个神经元在不同深度的动态荧光轨迹,还证明了该技术在介观尺度下对高度动态过程的捕捉能力。
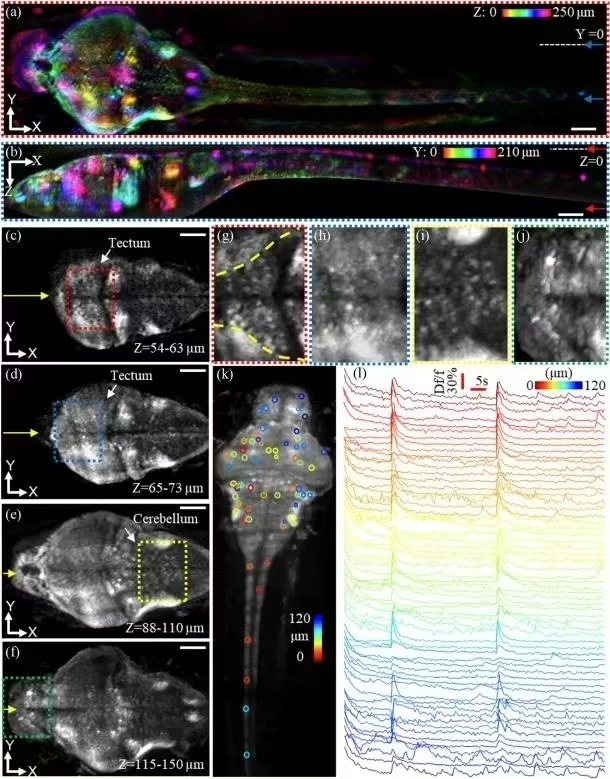
∆ 图:斑马鱼幼虫全身神经元活动记录,具有 3D 细胞分辨率[3]
小结:“大视场+高分辨率+低损伤”的完美平衡
♚
更好用的全场景智能单物镜光片
SmartView
一方面,可以具有开放式的样本操作空间,使其不再需要特制样本载具,适用于共聚焦培养皿、多孔板、类器官芯片、载玻片等标准载具;另一方面,可以实现物镜倍率的灵活切换(4 ×-100 ×),可适配油镜。从亚细胞结构到活细胞,从类器官到全器官,SmartView 能满足不同应用场景的需求。
结合光片显微镜光毒性低的特点,可实现对活细胞的精细动态和相互作用进行快速、三维、长时程地观测。使得光片显微镜的优势能够最大的发挥出来。
参考文献(略)






